
Descrição e conteúdos Abordados
Experimento que mostra o movimento de convecção do ar necessária para realimentar a chama de uma vela acesa.
Modo de fazer
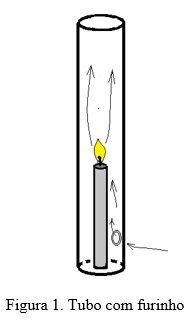
- Acenda a vela e coloque o tubo sobre ela, cuidadosamente para que a chama não se apague. O furinho deve ficar para baixo, conforme Figura 1. Em seguida, assopre na frente do furinho e veja o que acontece. Em seguida, posicione o furinho na lateral e assopre novamente. O que aconteceu?
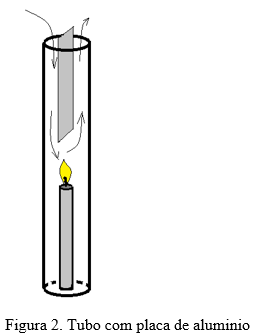
- Vire o tubo de ponta cabeça de forma que o furinho fique para cima. Coloque a plaquinha de alumínio dentro do tubo, apoiado na parte superior. Com cuidado, coloque o tubo sobre a vela, tentando manter a chama acesa.
- Retire a plaquinha de dentro do tubo e veja o que acontece.
Como é possível explicar esses três fenômenos?
Explicação
No caso da primeira parte do experimento, quando o tubo é colocado com o buraquinho na parte de baixo, parte dos gases quentes produtos da combustão tendem a subir por causa da sua menor densidade. Se não houvesse o furinho no tubo na parte de baixo, a chama se apagaria pois não haveria entrada de ar mais frio, com oxigênio para realimentar a chama. Este movimento é chamado de convecção.
Se assoprarmos o furinho pela parte da frente, estaremos introduzindo mais ar frio, realimentando ainda mais a combustão da chama. Mas, se assoprarmos o tubo deixando o furinho na lateral ou na parte de trás, a chama se apaga imediatamente. Neste caso, assoprando pelas laterais, pelo princípio de Bernoulli, a pressão do ar nas proximidades do furinho diminui, impedindo que o ar frio entre. Quanto maior a velocidade do ar, menor a sua pressão.
Na segunda etapa, quando a plaquinha de alumínio é colocada dentro do tubo, a chama não se apaga. Nesse caso, a lâmina faz com que parte dos gases quentes suba por um dos lados o que faz com que o ar frio possa descer pelo outro lado, realimentando a chama. Se retirarmos a plaquinha, a chama imediatamente se apaga.
“CALOR LATENTE DE VAPORIZAÇÃO”
A evaporação absorve calor
Podemos observar a absorção de calor através da evaporação, por exemplo, quando derramamos álcool nas mãos. A evaporação do álcool causa em nós a sensação de frio.
Se usarmos clorofórmio (líquido mais volátil), o frio produzido pode até provocar insensibilidade da parte do corpo aonde passamos o líquido. Esta propriedade era utilizada nas operações cirúrgicas, como anestesia.
Podemos citar outros exemplos do frio produzido pela evaporação:
- O frio que sentimos quando saímos do banho com o corpo molhado;
- O resfriamento da atmosfera após uma chuva no verão provém da rápida evaporação da água que caiu, pois o solo e o ar ambiente fornecem calor para esta evaporação;
- A evaporação do suor se dá através da retirada de calor do próprio corpo, regulando a temperatura dos animais de sangue quente;
- Os filtros de cerâmica porosa permitem a evaporação da água pelas paredes da mesma, retirando calor do líquido, conservando-a mais “fresca”.
- As geladeiras, “freezers” e aparelhos de ar condicionado são exemplos de frio produzido pela evaporação e expansão de líquidos voláteis.
Enfim, como água ocupa ¾ da superfície do globo podemos verificar o papel importante que ela desempenha na regularização dos climas.
Reciprocamente, assim como a evaporação absorve calor, a condensação fornece calor. Portanto, a evaporação pode ser empregada como fonte de frio e a condensação como fonte de calor.
CALOR LATENTE DE VAPORIZAÇÃO
Chama-se calor latente de vaporização ( L ) de um líquido a t 0C, a quantidade de calor absorvido pela unidade de massa do líquido para transformar-se em vapor, a t 0C. O calor latente de vaporização da água a 100 0C é 537 cal/g. Isto quer dizer que l g de água a 100 0C exige 537 calorias para transformar-se em 1g de vapor a 100 0C.
O calor de liquefação tem o mesmo valor numérico do calor de vaporização, ou seja, a quantidade de calor desprendido pela unidade de massa do vapor para transformar-se em líquido, à mesma temperatura.
Cada substância tem seu calor de vaporização. A água é a substância que tem o maior calor de vaporização. Ela tem também o maior calor de fusão ( 80 cal/g) e o maior calor específico (1cal/goC).
Portanto, é a substância que absorve maior quantidade de calor para fundir-se, aquecer-se e vaporizar-se.
Material Utilizado
-
Uma vela cortada ao meio
-
Um tubo de vidro com um furo próximo de uma das extremidades
-
Uma plaquinha de alumínio
Equipamento construído e doado por Claudio Hiroyuki Furukawa para o Laboratório de Demonstrações da UFPA.
Links Relacionados
Artigos em português
Artigos em outros idiomas
Vídeos em Português
Vídeos em outros idiomas
Redes Sociais